Quím.
Abril 20/2020
Guía de trabajo N°2
Lee atentamente el contenido de la guía y realiza las actividades propuestas
DETENER LA PROPAGACIÓN DEL COVID 19 ES UN COMPROMISO DE
TODOS
|
|
GUIA DE
TRABAJO EN CASA
Área y/o asignatura: QUÍMICA Grado: 10°
Curso: 1, 2 ,3 Período Académico: II
FECHA: ABRIL
20- 30 -2020
DOCENTE: MARÍA AUXILIADORA SALGADO R.
NOMBRE DE LA UNIDAD: SISTEMA PERIÓDICO DE LOS ELEMENTOS Y
ENLACE QUÍMICO
|
|
Propósitos de aprendizajes:
1. Repasar conceptos referentes a la
estructura atómica
2. comprender la estructura del
modelo atómico de Bohr e identificar los niveles de energía
3. Identificar niveles de energía,
orbitales y electrones
4. identificar cada uno de los
números cuánticos y su significado
5.
comprender de qué manera se distribuyen los electrones en el átomo en niveles
de energía, subniveles y orbitales
6.
Realizar consultas necesarias para la comprensión del tema
|
Contenidos temáticos:
El modelo
atómico actual: modelo de Bohr Números cuánticos
Historia de la
tabla periódica (Dobereiner, Newlands, Mendeleiev, Mosseley) La distribución
electrónica y tabla periódica Propiedades periódicas
Enlace químico.
Fórmulas químicas
Funciones químicas
de compuestos inorgánicos Nomenclatura
química inorgánica
|
SUGERENCIAS PARA EL DESARROLLO DE LA GUÍA Y APRENDIZAJE EN
CASA
|
|
Recuerda que en
nuestra institución tu aprendizaje está fundamentado en un modelo en el que
desarrollas interés por aprender, a
partir de conocimientos previos. Estos
conocimientos que tú traes, a partir de tu relación con el medio que te
rodea, te sirven para seguir generando nuevos aprendizajes, en los que se te entregan las herramientas
necesarias para que tú mismo construyas tus propios procedimientos y así
estés en capacidad de resolver una situación problémica.
Dadas las circunstancias actuales en la que los gobiernos de cada país
han decretado medidas preventivas de confinamiento para la
prevención del coronavirus o covid19, la educación virtual es la
alternativa que mejor podemos adaptar; por ello vamos a recurrir a la
observación de videos tutoriales, utilización de medios de comunicación
virtual como correos electrónicos, WhatsApp, plataformas virtuales y otros
medios físicos como guías de estudio para los estudiantes que no poseen los
medios y las herramientas para su ejecución.
La correcta distribución de tu tiempo como estudiante es un aspecto
fundamental para hacer posible una experiencia enriquecedora. Con estas guías
estamos realizando un primer ejercicio de transformación de la educación donde estudiantes y
docentes estamos aprendiendo.
Todos los conceptos aquí referenciados, así como los ejercicios con su
respectiva solución, DEBEN SER
CONSIGNADOS EN EL CUADERNO, lo cual se constituye en evidencia para la
valoración del período académico. De tal manera que una correcta disciplina y
organización de horarios de estudio en casa, se constituyen en LA RUTA EFICAZ PARA UN CORRECTO
APRENDIZAJE
|
|
MOMENTO 1 : EXPLORACIÓN DE SABERES PREVIOS
|
|
EL ÁTOMO
Recuerda que un átomo es la mínima porción de
un elemento que conserva sus propiedades. El átomo se concibe como esférico,
compuesto por un núcleo central, muy denso, en el que se encuentran los
neutrones (partículas sin carga eléctrica) y se concentran los protones
(partículas con carga positiva), del núcleo depende el 99,97% de la masa del
átomo y ocupa una diez billonésima parte del volumen atómico, está rodeado
por uno o más electrones que poseen carga negativa y se mueven alrededor del
núcleo.
Antes de continuar con nuestro estudio,
observa los siguientes videos˲:
ESTRUCTURA DEL ATOMO
En la guía anterior, estudiaste las teorías
atómicas de Dalton, Thomson y Rutherford, en esta vamos a continuar con otros
apartes importantes para conocer como está constituido el átomo
En un lapso de 35 años, comprendidos de 1897 a
1832, se descubrieron tres partículas subatómicas: protones, electrones y
neutrones.
De este modo, la parte central del
átomo, el núcleo
atómico, tiene una carga positiva en la que se concentra casi toda su masa,
mientras que en el escorzo, alrededor del núcleo atómico, hay un cierto
número de electrones, cargados negativamente. La carga total del núcleo
atómico (positiva) es igual a la carga negativa de los electrones, de modo
que la carga eléctrica total del átomo sea neutra.
Esta descripción de los
electrones orbitando alrededor del núcleo atómico corresponde al
sencillo modelo de
Bohr. Según la mecánica
cuántica cada partícula tiene una función
de onda que ocupa todo el espacio y los electrones no se encuentran
localizados en órbitas aunque la probabilidad de presencia sea más alta a una
cierta distancia del núcleo.
|
|
MOMENTO 2: CONCEPTUALIZACIÓN
|
|
MODELO ATOMICO DE BOHR
Niels
Böhr,
desarrolló un modelo sobre el comportamiento de los electrones en el átomo de
hidrógeno. Böhr supuso que el átomo de hidrógeno constaba de un protón
central alrededor del cual se movía el electrón en órbitas circulares o niveles de energía. Relacionó la fuerza
de atracción del protón y el electrón con la fuerza centrífuga debida al
movimiento circular del electrón.
Böhr dedujo que cada nivel de energía de un átomo sólo es capaz de mantener
cierto número de electrones a la vez. El número máximo de electrones o
población electrónica máximo por nivel de energía se calcula según la fórmula
2n2. En la cual n es igual al número del nivel de energía que se
está llenando, como se muestra en la tabla
Por
ejemplo, el diagrama de Böhr para el sodio es:
El
círculo central representa el núcleo del átomo, en el cual se hallan 11
protones y 11 neutrones; los círculos exteriores representan los niveles de
energía, los cuales se representan por las letras K, L, M… o con los números
arábigos 1, 2, 3… Bohr propuso un modelo planetario para el átomo, como si el
sol fuera el núcleo y los electrones los planetas que giran en niveles de
energía cuantizados en torno al núcleo.
MODELO MECÁNICO CUÁNTICO DEL ÁTOMO
La teoría cuántica o mecánica cuántica se
formuló durante los primeros treinta años del siglo XX, por los científicos Max Planck, Albert Einstein, Niels Böhr,
Louis De Broglie, Erwin Schrödinger, Wolfgang Pauli, Werner Heisenberg y Paul
Dirac.
En 1924, Louis
De Broglie postuló que el electrón tiene naturaleza dual, se comporta
como partícula y como onda. Siendo el electrón una onda era muy difícil
determinar la posición del electrón dentro del átomo.
En 1920, los científicos se
convencieron de que el modelo de Böhr debía ser abandonado porque no
correspondía a la realidad. Se
desarrolló la mecánica cuántica para describir e movimiento de pequeñas
partículas confinadas en una pequeña porción del espacio.
En 1926,
Erwin Schrödinger,
desarrolló una ecuación cuya solución está asociada a una serie de números cuánticos, por medio de los
cuales es posible calcular las energías permitidas al electrón en el átomo de
hidrógeno y de los demás átomos. Estos números cuánticos son:
1.
NÚMERO CUÁNTICO PRINCIPAL n
Indica
el nivel de energía donde se encuentra el electrón, asume valores enteros
positivos, del 1 al 7
2.
NÚMERO CUÁNTICO SECUNDARIO ("l") :
Toma valores desde 0 hasta n -1, llamado también azimutal. Determina la forma de la nube electrónica.
Físicamente corresponde a la zona más
probable donde encontrar un electrón. El número cuántico secundario o
azimutal es propio de cada orbital y es independiente del nivel energético en
el que probablemente se encuentre el electrón. De acuerdo a esto, l toma valores enteros entre 0 y (n-1), cada valor designa un subnivel y a cada uno de ellos se le
asigna una letra: s, p, d, f
Orbital s (l=0):
Ø Tienen
forma esférica
Ø La
probabilidad de encontrar un electrón es la misma
en
todas las direcciones radiales
Ø La
distancia media del electrón al núcleo
sigue al orden 3s > 2s. > 1s˲
Orbitales p (l=1):
Ø Tienen
forma de elipsoides de revolución y se
Ø diferencian
sólo en la orientación en el espacio
Ø Un
electrón que se encuentra en el orbital px
pasa la mayor parte del tiempo en las
proximidades
del eje X. análogamente ocurre con py
y pz
Ø Los
tres orbitales np tienen igual forma y tamaño
Ø Tienen
direcciones y tamaños distintos a los p
3.
NÚMERO CUÁNTICO MAGNÉTICO ("ml"):
Representa
la orientación de la forma espacial de cada orbital según un eje arbitrario
de referencia que viene dado por un campo magnético externo. Este número
magnético depende del número secundario o azimutal y toma valores desde –l hasta +l
(para cierto valor de l hay 2l+1 valores de m)
Por
lo tanto:
La forma de nombrarlos es, o bien a través
de sus números cuánticos, o bien colocando en primer lugar el valor del
número cuántico principal, después la letra asignada para el valor del número
cuántico secundario y a continuación la letra o letras de los ejes
coordenados del espacio como subíndice; por ejemplo:
n = 1
, l = 0 , m = 0
à
(1 , 0 ,
0) à
orbitales 1s
n = 3 , l = 2 , m =
1 à
(3 , 1 ,
1) à
orbitales 3px
n = 5 , l = 2 , m = ‑2
à
(5 , 2 , -2) à
orbitales 5dxy
4.
NUMERO
CUÁNTICO DE SPIN O GIRO ms :
Clásicamente representa el movimiento de rotación del electrón
alrededor de sí mismo, así como lo hace la tierra en su movimiento de
rotación alrededor de su propio eje. El electrón, como carga eléctrica en
movimiento, crea un campo magnético que puede ser del mismo sentido o de
sentido opuesto a otro campo magnético externo. Al poder tener sólo dos
sentidos de giro sobre sí mismo, "s" sólo podrá tomar 2 valores +½
y ‑½.
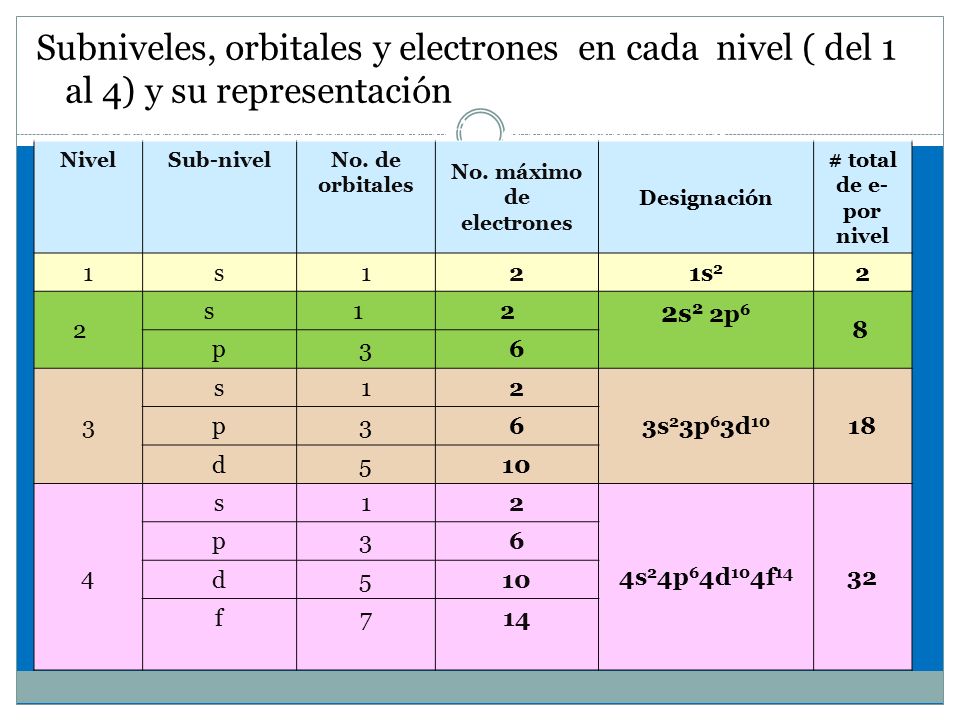
En la siguiente tabla
se observa que el primer nivel de energía solo posee un subnivel s, el segundo nivel de energía posee
subniveles s y p, el tercer nivel
de energía posee subniveles s, p y d,
el cuarto nivel de energía posee subniveles s, p, d y f. El subnivel s, tiene orbital s, con simetría esférica. Cada subnivel p contiene 3 orbitales p, formados por dos lóbulos
idénticos con la misma energía pero que se proyectan con distinta orientación
en el espacio, px, py, pz. El subnivel d contiene cinco orbitales y el
subnivel d tiene 7 orbitales con formas más complejas que los orbitales
|
|
MOMENTO 3: APLICA Y RESUELVE
|
|
MECÁNICA CUÁNTICA.
1.
Elige razonadamente cuál de estas dos afirmaciones es la correcta:
a)
La función de onda indica la localización exacta de un electrón con una
cierta energía cuantizada alrededor del núcleo.
b)
Un orbital es la representación de la probabilidad de encontrar un electrón
con una cierta energía en un elemento de volumen situado a una cierta
distancia del núcleo
2.
Explica brevemente una diferencia fundamental entre los conceptos de órbita,
del modelo atómico de Bohr y orbital, del modelo atómico de la nube de carga.
3.
Al aumentar n, el número de subniveles correspondientes a un nivel de energía
principal n-ésimo:
a)
Aumenta b) Disminuye c) Permanece constante
4.
Halla el número de orbitales contenidos en cada una de las cuatro primeras
capas. Induce una
fórmula
que permita calcular de forma inmediata el número total de orbitales
pertenecientes a una
capa
dada.
1.
Enumera los niveles y subniveles de energía y el número total de
orbitales que hay hasta el nivel
n=3
6.
Considera el nivel de energía principal tercero.
a)
¿Cuántos y cuáles subniveles contiene?
b)
Calcula el número total de orbitales en dicho nivel de energía.
c)
Calcula el número de orbitales del subnivel con l=2
7.
¿Cuántos subniveles posee el nivel de energía principal n = 4?
8.
Designa dichos subniveles utilizando la nomenclatura habitual.
9.
¿Cuántos orbitales tiene un átomo de hidrógeno en el cuarto nivel de energía
10.
¿Cuántos orbitales hay en el segundo nivel de energía principal?
12.
¿Por qué el subnivel de energía 2p puede alojar más electrones que el
subnivel 2s?
13. ¿Cuántos orbitales 3d existen? ¿Y cuántos
4d? (12.43)
14.
¿Qué letra se usa para identificar el subnivel l = 3? ¿En qué nivel principal
aparece por primera vez este subnivel? ¿Cuántos orbitales contiene?
La forma de los orbitales.
15. ¿En que se parecen los orbitales 1s y 2s
de un átomo? ¿En qué se diferencian? Indicar si pertenecen o no a la misma
capa.
16. ¿En que se parecen los orbitales 2p y 3p
de un átomo? ¿En qué se diferencian? Indicar si pertenecen o no a la misma
capa.
17. ¿En que se parecen los tres orbitales 2p
de un átomo? ¿En qué se diferencian? ¿Pertenecen a la misma capa? ¿Y al mismo
subnivel?
18. ¿En que se parecen los cinco orbitales 3d
de un átomo? ¿En qué se diferencian? ¿Pertenecen a la misma capa? ¿Y al mismo
subnivel?
19.-
¿Cuántos orbitales 3p y 2p hay? ¿Cuál de los dos grupos de orbitales posee
mayor energía? ¿En qué se diferencian?
Razona
si los subniveles a los que pertenecen dichos
orbitales:
a)
Poseen el mismo valor del número principal n.
b)
Poseen el mismo valor del número l.
Razona si los subniveles a los que pertenecen dichos
orbitales:
a)
Poseen el mismo valor del número cuántico principal n.
b)
Poseen el mismo valor del número cuántico secundario l.
c)
Poseen el mismo valor del número cuántico magnético, ml
siguiente
figura:
Es
decir, el electrón en ese orbital se mueve la mayor parte del tiempo en las
inmediaciones
del eje Z. tomando como único dato la figura dada, Razona si
es
posible conocer el subnivel de energía al que corresponde dicho orbital.
| |
Ahora te invito a que observes el siguiente vídeo para que comprendas con más claridad el tema:
Mayo 18/2020
Guía de trabajo N°3
Lee atentamente el contenido de la guía y realiza las actividades propuestas
Fecha límite de entrega de evidencias: mayo 30/2020
junio 9/2020
Guía de trabajo N°4
Lee atentamente el contenido de la guía y realiza las actividades propuestas